Tối 29/8, Bộ Y tế thông tin chính thức kết luận cuộc họp của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Hội đồng tư vấn) đối với hồ sơ đề nghị cấp giấy đăng ký lưu hành vaccine Nano Covax do Công ty cổ phần công nghệ sinh học dược Nanogen đăng ký và sản xuất.
Cuộc họp diễn ra từ 8h đến 15h ngày 29/8 với sự tham gia của Hội đồng tư vấn; lãnh đạo các vụ, cục liên quan và đại diện Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia, các chuyên gia thẩm định thuộc các tiểu ban.
Tại cuộc họp, sau khi nghe báo cáo của các tiểu ban chuyên môn thẩm định hồ sơ và kết luận của Hội đồng Đạo đức ngày 22/8, các thành viên Hội đồng tư vấn cấp Giấy đăng ký lưu hành thuốc và nguyên liệu làm thuốc đã thảo luận và xem xét kỹ lưỡng các nội dung liên quan của hồ sơ đăng ký vaccine Nano Covax.
Vaccine Nano Covax sử dụng công nghệ protein tái tổ hợp, là vaccine ngừa Covid-19 đầu tiên của Việt Nam thử nghiệm lâm sàng
Tất cả các thành viên Hội đồng tư vấn đã thống nhất kết luận:
Bộ phận thường trực Hội đồng tư vấn và các đơn vị liên quan đã rất khẩn trương, sát sao hướng dẫn doanh nghiệp hoàn thiện hồ sơ trong thời gian sớm nhất theo đúng tinh thần cấp bách và quy trình cuốn chiếu. Hội đồng tư vấn đã nghiên cứu rất kỹ và xem xét một cách cẩn trọng hồ sơ. Hồ sơ đã được Tiểu ban Pháp chế thẩm định 2 lần, Tiểu ban Chất lượng thẩm định 4 lần, Tiểu ban Dược lý, Lâm sàng thẩm định 3 lần.
Các ý kiến thẩm định của các tiểu ban chuyên môn đối với hồ sơ pháp lý, chất lượng, dược lý, lâm sàng và kết luận của Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia (Hội đồng Đạo đức) là cơ sở để Hội đồng tư vấn thảo luận, xem xét việc cấp giấy đăng ký lưu hành vaccine Nano Covax.
Sau buổi họp, Hội đồng tư vấn ghi nhận các kết quả đạt được đối với hồ sơ đề nghị cấp giấy đăng ký lưu hành của vaccine Nano Covax đã được các tiểu ban chuyên môn thẩm định, Hội đồng Đạo đức nghiệm thu. Đồng thời, Hội đồng tư vấn đề nghị doanh nghiệp tiếp tục bổ sung, làm rõ các nội dung sau:
- Về hồ sơ chất lượng: Căn cứ kết quả thẩm định của tiểu ban chất lượng, đề nghị doanh nghiệp bổ sung, cập nhật một số nội dung theo ý kiến của tiểu ban chất lượng theo hình thức cuốn chiếu.
- Về hồ sơ dược lý, lâm sàng: Căn cứ kết quả thẩm định hồ sơ lâm sàng của Trung tâm Dược lý lâm sàng - Đại học Y Hà Nội và kết luận của Hội đồng Đạo đức ngày 22/8, Hội đồng tư vấn đề nghị:
- Về tính an toàn: Bổ sung, cập nhật thêm dữ liệu an toàn cho toàn bộ đối tượng đã được tiêm ít nhất một liều vaccine tới thời điểm hiện tại và giải thích rõ về các trường hợp sự cố bất lợi nghiêm trọng (SAE) tới thời điểm hiện tại.
- Về tính sinh miễn dịch: Bổ sung, cập nhật dữ liệu theo đề cương sửa đổi mới nhất được Hội đồng đạo đức thông qua, bao gồm đánh giá tính sinh miễn dịch trên các biến chủng mới (ví dụ biến chủng Delta, biến chủng Anh…) và cỡ mẫu đánh giá tính sinh miễn dịch cần thực hiện theo đúng đề cương nghiên cứu đã được thông qua.
- Về hiệu quả bảo vệ: Đề nghị doanh nghiệp phối hợp với nhóm nghiên cứu để phân tích, bàn luận về mối liên quan giữa tính sinh miễn dịch của vắc xin và hiệu quả bảo vệ tối thiểu 50% (theo hướng dẫn của Tổ chức Y tế thế giới - WHO) dựa trên các dữ liệu y văn.
Công ty cổ phần công nghệ sinh học dược Nanogen cần khẩn trương bổ sung, cập nhật các nội dung này, báo cáo Hội đồng Đạo đức và Hội đồng tư vấn tiếp tục xem xét, thẩm định cuốn chiếu các kết quả nghiên cứu để có thể cấp giấy đăng ký lưu hành có điều kiện trong trường hợp cấp bách.
Trước đó, trong các ngày 20-22/8 Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia vừa chấp thuận kết quả thử nghiệm lâm sàng giai đoạn 3a đối với vaccine phòng COVID-19 Nano Covax do Công ty Cổ phần Công nghệ sinh học dược Nanogen phối hợp với Học viện Quân y nghiên cứu và sản xuất.
Theo đó, bước tiếp theo, hồ sơ và dữ liệu nghiên cứu của vaccine Nano Covax sẽ được chuyển sang Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Bộ Y tế) để họp xem xét cấp phép sau khi Hội đồng Đạo đức có biên bản nghiệm thu kết quả thử nghiệm.
Trước đó, Hội đồng Đạo đức đã họp, thẩm định báo cáo giữa kỳ giai đoạn 3a thử nghiệm lâm sàng của vaccine Nano Covax, đánh giá về tính an toàn và tính sinh miễn dịch.
Báo cáo của nhóm nghiên cứu cho thấy, giai đoạn 3a thử nghiệm trên 1.004 tình nguyện viên, những người đã được tiêm 2 mũi cách nhau 28 ngày có kết quả đạt yêu cầu về tính an toàn. Khả năng trung hòa virus sống của vaccine tại thời điểm ngày thứ 42 (14 ngày sau tiêm mũi 2) là 96,5%.
Qua kết quả thử nghiệm pha 2 và pha 3a, nhóm nghiên cứu kết luận vaccine Nano Covax đạt yêu cầu về tính sinh miễn dịch, từ đó, kiến nghị tiếp tục thực hiện nghiên cứu pha 3b trên 12.000 tình nguyện viên đảm bảo an toàn, đúng tiến độ và đề xuất các cơ quan chuyên môn xem xét cấp phép khẩn cấp có điều kiện cho vaccine Nano Covax.
Nano Covax vaccine “Made in Viet Nam” có nhiều triển vọng
Nano Covax là vaccine ngừa Covid-19 do Việt Nam nghiên cứu và sản xuất. Trước khi đưa ra thử nghiệm lâm sàng, Nano Covax đã đạt tất cả chỉ tiêu tiền lâm sàng, được các cơ quan chức năng kiểm duyệt nghiêm ngặt. Mũi tiêm đầu tiên được thực hiện vào ngày 17/12/2020.
Vaccine sử dụng công nghệ protein tái tổ hợp, lấy trình tự một đoạn S protein gai trên nCoV, tích hợp nó vào một dòng tế bào động vật đang nuôi cấy để tạo ra protein của virus, rồi pha chế với các tá dược khác nhằm tạo ra vaccine.
Sáng 22/8, Hội đồng Đạo đức, Bộ Y tế, tiếp tục thẩm định kết quả lâm sàng giữa kỳ giai đoạn 3a vaccine ngừa Covid-19 Nano Covax của Công ty Nanogen.
Hội đồng đạo đức vẫn xem xét kỹ báo cáo trước khi đưa ra thông cáo báo chí cuối cùng. Như vậy với kết quả này, chỉ còn một bước, Nano Covax có thể trở thành vaccine Covid-19 đầu tiên “made in Vietnam” được cấp phép.
Theo báo cáo, giai đoạn 3a thử nghiệm trên 1.004 tình nguyện viên ở Hà Nội và Long An. Đây là nghiên cứu ngẫu nhiên, mù đôi, có đối chứng giả dược với tỷ lệ 6:1 (6 người tiêm vaccine, 1 người tiêm giả dược).
Các tình nguyện viên bắt đầu tiêm mũi 1 từ ngày 8/6, sau 28 ngày tiêm mũi 2 và kết thúc theo dõi vào đầu tháng 6/2022.
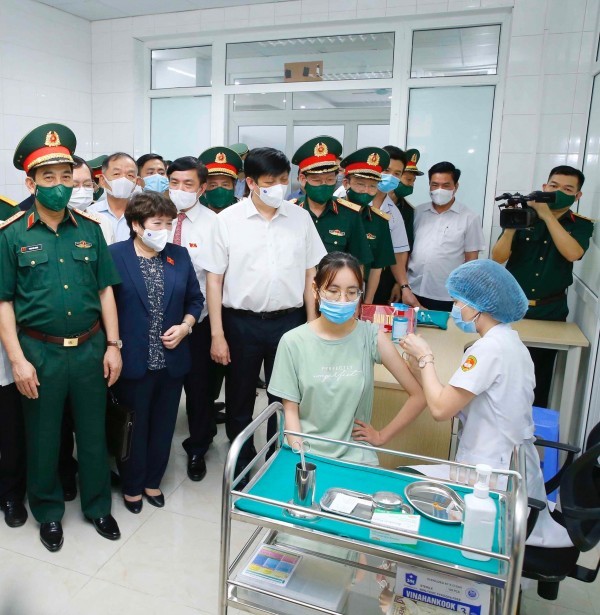
Bộ trưởng Bộ Y tế Nguyễn Thanh Long và Bộ trưởng Quốc Phòng Phan Văn Giang hỏi thăm, động viên tình nguyện viên tiêm thử nghiệm vắc xin phòng COVID-19 Nano Covax.
Ở giai đoạn 3a, số lượng mẫu tham gia đa dạng về nhóm tuổi (18-81 tuổi). Trong đó, nhóm 18-45 tuổi chiếm 60%, 46-60 tuổi chiếm 22%, hơn 17% còn lại là nhóm trên 60 tuổi. Giai đoạn này cũng cho phép các tình nguyện viên có tiền sử dị ứng, bệnh tim mạn tính, đái tháo đường, tăng huyết áp, từng mắc ung thư, người béo phì…, tham gia, với tổng 162 người.
Tuy nhiên, chỉ có 988 người tiêm đủ 2 mũi. Trong đó, 925 người có đủ dữ liệu đánh giá ở thời điểm ngày thứ 42. Kết quả thu được từ 856 người tiêm mũi 1 và 824 người tiêm mũi 2 cho thấy vaccine Nano Covax đạt yêu cầu về tính an toàn.
Đánh giá giữa kỳ giai đoạn 3a cho thấy vaccine Nano Covax có tỷ lệ chuyển đổi huyết thanh lên tới 99,2% ở ngày thứ 42.
Kết quả đánh giá hiệu giá kháng thể trung hòa virus bằng phương pháp PRNT50 của những người đã tiêm vaccine Nano Covax cho thấy ở thời điểm ngày thứ 42 sau tiêm mũi 1 và là ngày 14 sau tiêm mũi 2, tỷ lệ có khả năng trung hòa virus sống là 96,5%.
Trung bình nhân hiệu giá kháng thể PRNT50 với chủng Vũ Hán là 63,5 trong khi ở nhóm giả dược là 5.
PRT50 được coi là “tiêu chuẩn vàng” để phát hiện và đo lường các kháng thể có khả năng vô hiệu hóa virus hay không. Trong phòng thí nghiệm, máu của người tiêm vaccine sẽ được pha loãng, trộn chung với virus sống để đánh giá hiệu quả bảo vệ của vaccine.
Trong khi đó, đánh giá kết quả giai đoạn 2 do Viện Pasteur TP.HCM thực hiện trên chủng SARS-CoV-2 ở Vũ Hán, công bố ngày 6/8, cho thấy hiệu giá kháng thể trung hoà của vaccine Nano Covax cao gấp hơn 2 lần so với nhóm khỏi bệnh, tương đương hiệu quả bảo vệ là 90% trong việc ngăn ngừa Covid-19 có triệu chứng.
Sau khi tiêm vaccine 3 tháng, hàm lượng kháng thể đặc hiệu của người tiêm Nano Covax vẫn cao hơn 3 lần so với nhóm khỏi bệnh.
Gộp chung giai đoạn 2 và 3a, nhóm nghiên cứu kết luận trung bình nhân nồng độ kháng thể Anti-S-IgG đạt 57.56 U/ml, tăng gấp 218.93 lần sau 42 ngày tiêm vaccine. Tỷ lệ chuyển đổi huyết thanh đạt 99.2%.
Đại diện Nanogen cho biết dựa trên các kết quả thử nghiệm lâm sàng, khả năng sinh miễn dịch của vaccine Nano Covax đạt 99,4%. Kết quả thử nghiệm vaccine Nano Covax giai đoạn 1 rất an toàn, khả năng tạo kháng thể và trung hòa virus tốt, thậm chí tạo được kháng thể chống lại virus biến chủng mới của Anh (B117).
Giá bán của vaccine này chỉ khoảng 120.000 đồng/liều. Đến nay, công suất sản xuất của nhà máy ước đạt 8-12 triệu liều/tháng.
Dựa trên kế hoạch và năng lực hiện tại, công ty dự kiến đến tháng 12 năm nay có thể cung cấp đủ 50 triệu liều và 100 triệu liều vào năm 2022.
Trước đó, Bộ Y tế và Hội đồng đã thông qua đề cương nghiên cứu, triển khai thử nghiệm lâm sàng giai đoạn 3 cho Nano Covax hàm lượng 25 mcg trên quy mô 13.000 người.
Ngày 22/6, Công ty Nanogen gửi đơn xin cấp phép khẩn vaccine Nano Covax. Song song với việc xin cấp phép sử dụng khẩn cấp có điều kiện, Nanogen kiến nghị Bộ Y tế, Hội đồng Đạo đức trong nghiên cứu y sinh quốc gia xem xét việc triển khai nghiên cứu giai đoạn 3c (tiêm cho khoảng 500.000 - 1.000.000 người); đặc biệt cho phép được nghiên cứu trên trẻ em 12 - 18 tuổi sau khi được cấp phép.












